地下水が酸性になる前に−土壌の緩衝能とその限界−
酸性雨シリーズ(5)
久保井 徹
ある朝,突然,井戸水が酸っぱくなっていた・・・。長年,大地に降りそそいだ酸性雨によって,いつの日か,こんなことがおこるかもしれない。ガラス管につめた土壌(石灰汚泥によりアルカリ化した火山灰土壌)に希硫酸をかけ流すと,浸透水のpHは高いままで推移した後,急激に低下する(図参照)。低下までに加えた酸の量は,野外の土壌が1年間に受ける量の百〜千倍に相当する。
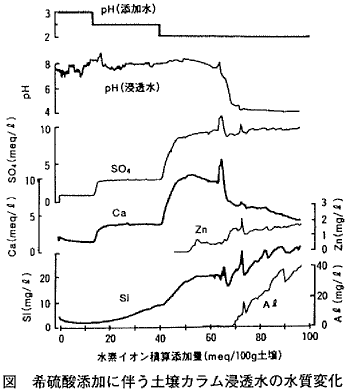
酸に対する土壌の緩衝機構はいくつもあることが知られている。図と表に示した結果から,これらの機構が連続して作用している状態をみてみよう。まず目につくのは,添加水のpHに応じて浸透水中のカルシウム(Ca)と硫酸(SO4)イオンの濃度が高まっていることだろう。これは主に陽イオン交換反応(本ニュース,5巻5号参照)で説明できる。土壌中の粘土や有機物は通常マイナスに帯電しており,Caなどの陽イオンを吸着している。水素イオンは土壌の負荷電と親和性が高いために,吸着していたイオンは置き換えられ,CaSO4などとして溶出する。
Caは,土壌に沈着している炭酸カルシウムからも溶け出している可能性が高い。添加した酸により炭酸塩が溶解する過程で,炭酸の一部はガス化し,水素イオンは炭酸−重炭酸平衡反応によって消費される。この緩衝機構が酸添加の初期に働いている兆候は,浸透水中のCaとSO4のモル比が初期に高く,次第に1に近づいている(表参照)ことから読み取れる。なお,用いた土壌では水素を除く陽イオンのほとんどをCaが占め,強酸性陰イオンのほぼ全てがSO4になっている。
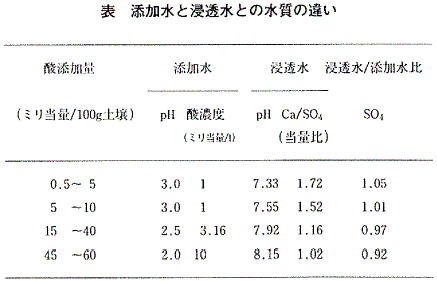
第3の機構は,水素イオン負荷総量が増えるに従ってSO4濃度の浸透水/添加水比が低くなっている(表参照)ことと関連する。土壌が水素イオンを多量に吸着するとプラスに帯電する部分ができ,SO4イオンも捕捉されて酸自体が消滅するためと考えられている。第4の機構は粘土の破壊,すなわち土壌の不可逆的な変化を伴う。これは,粘土の主成分であるケイ素(Si)が浸透水に少しずつ溶け出していることから明らかになる。水素イオンを消費するこの反応によって,アルミニウム(Al)の水酸化物も生成するが,この時点では未だ土壌に保持されている。
これらの緩衝機能が限界を越えると,pHの低下とともにAl,マンガンや亜鉛などの吸着性が高い元素も急激に可溶化する。このような状況でも,浸透水のpHは添加水よりも高く維持されており,Alの緩衝能(各種のAl水酸化物間の平衡反応)が働いている。Alが流れ去って第5の緩衝機能すらも失われることは,現実にはほとんど起こり得ない。
この実験では生物活動を考慮していないので評価できないが,植物や土壌生物も,呼吸による炭酸ガスの放出や酸の吸収,有機物の供給などによって土壌の酸耐性に貢献している。ほ場試験では,土壌溶液のpHとアルカリ度が裸地区より栽培区においてはるかに高い結果を得ている。
土壌の種類や履歴により,ここに示した緩衝機構が寄与する比率は異なり,第1〜3の機構による緩衝能が非常に小さい土壌も多い。土壌化学的な知識を基にして酸性雨の影響予察図が作られてはいる(環境庁;1984)が,酸性雨による土壌環境の変化を監視する手法は未だ確立していない。私も大量の土壌に希硫酸(pH3.5)をかける実験(ライシメータ試験)を4年間続けているが,第1と2の機構に伴う変化がやっと検知できているにすぎない。
地下水の酸性化は,外国ではすでに現実のものとなっており,被害も報告されている(朝日新聞;1989年6月20日付)。このような状況が日本でもみられる前に,土壌中で起こっている変化とその影響を解明し,対策を立てておく必要がある。


