大気中でのオゾン生成プロセス
コラム1
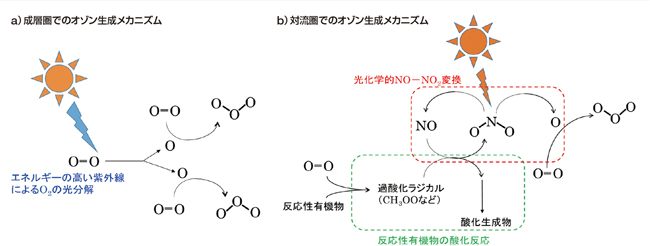
オゾン(O3)は、大気中で酸素分子(O2)から生成する酸素原子(O)とO2の結合反応によって生成する酸化力の強い物質です。私たちの身の回りの大気にあるオゾンは、その強い酸化力による負の側面(例:健康被害や植物・作物被害)から、しばしば「悪いオゾン」と呼ばれています。一方で、高度約10~50kmにある成層圏オゾン層のオゾンは太陽光に含まれる有害紫外線を吸収するフィルターとしての役割があり、時として「良いオゾン」と呼ばれています。大気でのオゾン生成の鍵となるO2からのO原子の生成のメカニズムは成層圏と対流圏(地表面~高度約10km)で異なります。成層圏では、短い波長(高いエネルギー)の紫外光によってO2が直接光分解されてO原子が生成します(図1-a)。一方、オゾン層の紫外線フィルター効果のため、対流圏に到達する太陽光にはO2を分解できる紫外光は含まれていません。
対流圏でのオゾンの生成で重要なのが、COやメタンなどの反応性の有機化合物と窒素酸化物の存在です。大気中で反応性有機化合物が酸化される過程で、O2は過酸化ラジカル(例えば、HOOラジカルやCH3OOラジカル)と呼ばれる活性種に変換されます。この過酸化ラジカルの酸素原子間(O-O)の結合エネルギーはO2の半分程度であり、O-Oの結合が弱まっていることが分かります。さらに過酸化ラジカルの適度な酸化力により、大気中の一酸化窒素(NO)を二酸化窒素(NO2)に酸化できます。NO2は対流圏に到達する太陽光中の近紫外光(UV-A, B)でも光分解して、O原子を放出し、同時にNOが再生されます。NO→NO2変換は、対流圏に到達する太陽光を利用可能にし、NOが再生されることで、繰り返しNO→NO2変換が可能になります。このように対流圏では、COや反応性有機物の酸化反応によるO-Oの結合力の低下と、NO→NO2変換を通した太陽光の利用によって、O2からO3が生成します(図1-b)。