DNA情報による種分類-配列を調べないで配列の違いを知る-
●特集 DNAを通して自然を観る●
【シリーズ先導研究プログラムの紹介:「流域圏生態系研究プログラム」から】
玉置 雅紀
生き物の分類はDNA情報に置き換えられつつある
生物の研究では扱っている生き物の名前を正確に認識することが研究の出発点になります。しかし、実際の研究現場では生物種を認識するのが容易ではない場合も少なくありません。例えば卵や幼虫など、生き物の生活史のなかでも形が単純で見分けがむずかしい場合や、浜辺に打ち上げられた海藻の様に元の形を留めていない場合などがそれに当たります。このような場合には遺伝子を指標とした種判別を行うことがあります。詳しい内容は本号の環境問題基礎知識「DNAバーコーディング」に譲りますが、生物の持つDNA配列の一部分における塩基配列の違いを指標とした種分類手法がそれにあたります。この手法は今後生物種の分類方法の主流になっていくと考えられており、例えば被子植物では1990年代に葉や花の形を基に類縁関係を系統的に分類する手法から、DNA配列を基にした新しい分類体系であるAPG植物分類体系が導入されています。これにより新しい教科書や図鑑などではこの分類体系を採用するようになってきています。
DNA情報による分類は誰もが使える状況になっていない
生物の分類に使われる塩基配列情報、DNAバーコードはBOLDというデータベースに集められています。ここには動物で126,054種、植物で41,921種、カビなどその他の生物2,431種についてのDNAバーコード情報が載せられており(2013年1月8日現在)、今後もこの情報は日ごとに増えていきます。このような膨大なデータがある一方で、この蓄積された情報を実際の現場における生物の判別に活用することは残念ながら広くは行われていないようです。というのはこの方法による種判別のハードルがまだまだ高いからです。DNAバーコーディングでは知りたい生物の遺伝子の配列情報を知る必要がありますが、その情報を得るには、(1)対象生物からDNAを抽出する、(2)抽出したDNAからバーコードDNA断片をPCR法というごく少量のDNAから特定部位を大量に増やす技術で増幅する、(3)増幅したDNA断片の塩基配列を決定する、という工程が必要になります。このうち(1)については生物種によってはDNAを取るのが難しいこと、(3)については分析に必要な機器が高価であることが高いハードルの原因として挙げることができます。また、これらの工程を終えるまでに数日間は必要となることもこの手法の普及のための阻害要因となっています。したがって、本手法をより普遍的なものとするためには、手法の簡便化と解析コストの低減化が必要になります。
本稿では生物多様性プログラムにおいて行っている、環境指標生物であるユスリカのDNAバーコード情報を利用した簡便種判別手法及び、流域圏生態系研究プログラムにおいて行っている、グリーンタイド形成するアオサ種の簡便な種同定手法について解説します。なお、ユスリカについては国環研ニュースVol.10 No.1、グリーンタイドについては国環研ニュースVol.29 No.6で詳しく紹介しています。
簡単にDNAは取れるのか?
ある生物種をDNAバーコーディングによって知るための第一歩として、対象種からDNAを取る必要があります。生き物を乳鉢などでゴリゴリとすり潰すとそれだけでDNAは取れます。ですが、この抽出液中には同時にタンパク質や脂質など多くの混じりものが入ってきます。このままでは次の過程であるPCR法によるDNA増幅は、酵素反応が阻害されるために全く進みません。したがって、DNAを取る操作は他の混じりものとDNAとを分離する操作が中心になります。近年では市販のキット類が充実してきてこの操作は簡便になってきましたが、試料を破砕する過程を省くことができませんでした。一方で、この2-3年の間にPCR法に使われる酵素の性能が飛躍的に良くなったため、抽出液に混じりものがあってもPCR反応が阻害されにくくなってきました。そこで私はこの酵素を使った簡便なDNA増幅について検証を行いました。DNAは溶解液中に生物試料断片を投入し、10分間熱を加えるだけで抽出します。この方法で、海藻(アオサ)・植物の葉・米粒・鳥の糞・水中浮遊物質などからPCR法によるDNAの増幅を行うことができました。昆虫(ユスリカ)や動物からも同様な方法でDNA増幅できることが知られています。これによりDNAの抽出は熱処理できる機器さえあれば現場でも簡便に行うことができるようになりました。
どのように塩基配列の違いを表現するのか?
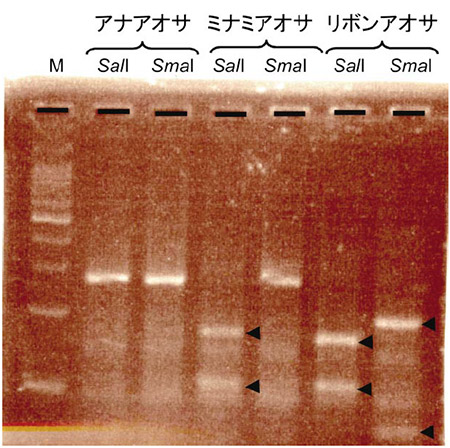
DNAの情報はA、T、G、Cの塩基の並びとして保存されています。それでは生物種ごとに異なるこの情報を塩基配列解読すること無しに区別することができるでしょうか?私が取った方法は2つあります。1つはPCR法により増幅したDNA断片を制限酵素という決まった塩基の並びを認識して切断する酵素で処理する方法です。この酵素処理により得られた試料をアガロースゲル電気泳動により大きさに応じて分離・染色することで、ゲル上に現れる切断DNA断片の長さや本数の違いを視覚化することにより間接的に配列の違いを認識します。この方法はPCR-RFLP(Restriction Fragment Length Polymorphism、制限酵素断片長多型)法と呼ばれています。図1に干潟でグリーンタイドを形成する主要な3種のアオサ、アナアオサ・ミナミアオサ・リボンアオサについてのPCR-RFLPによる分析例を示しました。これらのアオサ種のITS2というDNA領域をPCR法により増幅すると約250塩基のDNA断片が増幅しますが、3種のアオサから増幅したITS2のDNA断片は長さだけでは区別がつきません。ところが増幅したDNA断片の塩基配列を詳しく調べると、SalI(GTCGACを認識して切断)およびSmaI(CCCGGGを認識して切断)という制限酵素による認識配列を持つか持たないかで区別することができます。この解析例ではアナアオサのPCR産物中にはこれらの認識配列はありませんが、ミナミアオサではSalIの認識配列があり、リボンアオサではSalIとSmaIの両方の認識配列があります。そうすると、同じPCR産物をSalIまたはSmaIで処理した場合に、アナアオサではどちらの場合でも切断されないので1本のバンドしか見られないのに対し、ミナミアオサではSalI処理により切断され2本バンドに、リボンアオサではどちらの酵素で処理しても切断され2本バンドになります。したがって、干潟で取ってきた未同定のアオサから上記のようにDNAを抽出し、PCR反応を行い、制限酵素処理後長さにより分離することで少なくとも3種のアオサのうちどの種類であるのかを特定することができます。この方法を使えば塩基配列を読み取る従来の方法と比べて、時間は半分以下に、ランニングコストは1/5になります。そのため解析できるサンプル数が飛躍的に増加し、例えば東京湾におけるグリーンタイド構成アオサ種の季節変動などを高い精度で調べることができるようになりました。ですが、この手法の問題点としては対象とするDNA断片の中を認識する制限酵素がうまく見つからないと適用できない事が挙げられます。言い換えると運に左右される部分があることが欠点です。
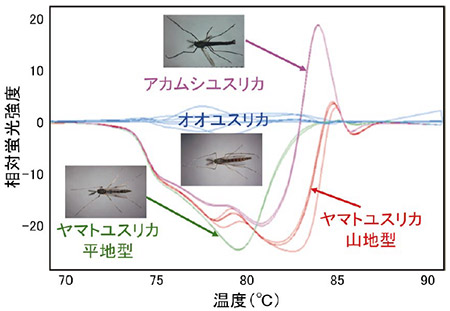
もう1つのPCR産物の解離温度を利用する方法はHRM法(High Resolution Melting、高感度融解温度曲線解析)と呼ばれています。この方法ではPCR反応を行う過程で合成されていく2本鎖DNAの間に特異的に入り込むと蛍光を発する物質を入れておきます。この状態でPCR反応を行うとDNAの増幅と共に蛍光物質が取り込まれ、PCR反応後には最大の蛍光強度を示すようになります。本手法ではここが出発点となります。蛍光強度が最大となった2本鎖DNAに今度は徐々に温度を上げていくとやがてある温度で2本鎖が解離していき蛍光物質が放出されるため、急激に蛍光強度の減少が観察されます。ここが2本鎖DNAの解離温度となります。この解離温度はDNAの配列によって異なりますので、同じ長さのDNA断片であっても解離する温度が異なれば元となるPCR産物の配列は違っていたということになります。具体的に霞ヶ浦に生息するユスリカのCOI遺伝子領域を用いてHRM解析による分類を行ったデータを図2に示します。この方法により得られるデータは温度上昇による2本鎖DNAの解離が極大となる温度をピークとしたグラフとして表されています。ピークの場所が異なれば解離温度が異なっており、ひいては元の塩基配列が異なっていたことになります。本手法は非常に鋭敏であり、元となるPCR産物の塩基配列のうち1つの塩基が異なる場合でもその違いを検出することが可能です。この方法を使えば塩基配列を読み取る従来の方法と比べて、時間は1/10以下に、ランニングコストは1/10になります。また、PCR-RLFP法と比較して塩基配列の並びの運に左右されないのが長所ですが、欠点としては普通のPCR装置よりも数倍程度高価な定量PCR装置が必要なことです。
以上のように私は生物の種判別をDNA情報に置き換えて簡便に行う手法の開発を行っており、研究レベルでは労力やランニングコストの低減化に成功しました。今回紹介した2つの手法はどちらもPCR法を基本としています。というのは、塩基配列の決定に使用するDNAシーケンサーの導入には数千万円必要ですが、PCR装置であれば百万円程度で導入可能だからです。しかしながら、PCR装置も比較的高価な機器であり、また両手法ともにDNA抽出と違って試料の採取現場で速やかに解析ができないという欠点もあります。今後は現場ですぐに生物種の同定を行えるように、PCR装置を必要としないDNA増幅手法を開発していく必要がありそうです。
執筆者プロフィール

学生時代から一貫して実験室での研究を続けてきたが、3年ほど前から同僚にくっついて現地調査にも行くようになった。現場で出てくるデータはばらつきが大きくて扱いが難しいが、身体を動かすのは楽しくてご飯が美味しいです。


