「TCDDの生殖・発生に及ぼす影響に関する研究」概要とその成果
Summary
ダイオキシン(TCDD)が生殖・発生に及ぼす影響について検討するため,妊娠15日のラットに,12.5,50,200,800,1600ng/kg体重のTCDDを1回投与して,出生後の子への影響を調べた。
1.胎盤機能への影響
環境中に存在するTCDDを含む極微量の有害物質は,胎盤のバリア機能でまず防御されるため,その影響は多くの場合,胎児に影響する前に胎盤機能の変化という形で起こると考えられています。しかし,これまでTCDDによる胎盤機能への影響についてはほとんど知られていません。
そこで今回は,妊娠ラットにTCDDを投与し,胎盤の組織を観察し,胎児の発育異常との関連性について考察しました。その結果,
(1) 対照群と比較して胎盤・胎児の重量の差はなかった。
(2) 妊娠20日(妊娠後期)の胎児の死亡が対照群,800ng/kg,1600ng/kg投与群でそれぞれ0,2,12%みられた。
(3) 妊娠20日のラットではTCDD(800,1600ng/kg)投与で胎盤グリコーゲン量に増加傾向が見られた。
妊娠20日の正常なラットの胎盤にはわずかしかグリコーゲン細胞は見られません。胎盤におけるグリコーゲン細胞の役割は不明ですが,糖尿病ラットなどの例では胎児の栄養物質輸送と密接に関連し,異常をきたした場合には組織レベルの変化が引き起こされることが推測されています。今回TCDDと胎盤のグリコーゲン量の変化についての直接的な因果関係はつかめませんでしたが,TCDDがグリコーゲンの代謝に何らかの影響を及ぼしている可能性が考えられました。
2.雄性生殖機能への影響
TCDDによる雄の生殖器官への影響はこれまでにも報告されています。TCDDの影響の中で,もっとも低い用量で変化の現われるものとして注目されています。
(1) 精巣重量,1日精子産生量,精巣上体(精巣から出た精子をいったん蓄えるところで,受精に必要となる変化が精子に起きるといわれている)重量については,これまでの報告と異なり,変化は見られなかった。
(2) 前立腺重量は,生後49日では800ng/kg投与群,同120日では200,800ng/kg投与群で減少が認められた。
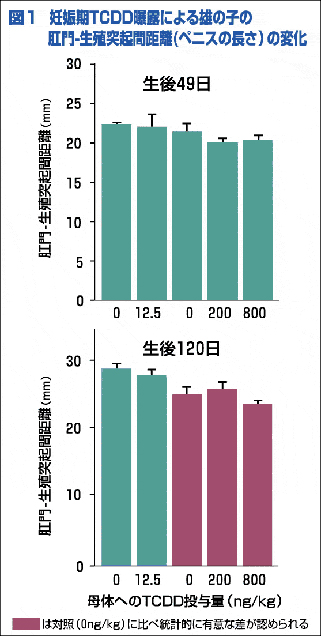
(3) 肛門-生殖突起間距離(ペニスの長さ)は,生後120日で50ng/kgという低用量でも影響が見られた。この50ng/kgという低値での影響は今回が初めての報告である。(図1)
デヒドロテストステロン(男性ホルモンの一種)により組織がつくられる前立腺やペニスは,これまでの報告どおり低用量域でも影響を受けることが証明されました。しかし,デヒドロテストステロンの量を決めているテストステロンからデヒドロテストステロンに変換する酵素のmRNAは,TCDDの投与により増加傾向が見られました。したがって,前立腺やペニスの発達を妨げたのはデヒドロテストステロンの量の減少ではないようです。では,何か他の原因があるのでしょうか?生後49日でアンドロジェンレセプター(アンドロジェンの受容体)のmRNAには減少が認められました。このことは,男性ホルモンであるアンドロジェンがいくら大量に作られても,それを認知し実際にアンドロジェンの役割を遺伝子に伝えるレセプターがないため,ホルモンの役割を果たせないということになります。つまり前立腺の発達抑制についてのTCDDの作用は,アンドロジェンそのものの抑制ではなく,そのレセプター側の抑制を通して影響を及ぼしていることが推測されました。
3.甲状腺機能への影響
PCBやダイオキシンは甲状腺ホルモンと構造が似ているので,低用量で影響を及ぼします。しかし,甲状腺に関してはPCBとダイオキシンでは違いがあります。PCBは甲状腺ホルモンを運搬するタンパク質と結合して,甲状腺ホルモンのT4濃度の低下を引き起こします。TCDDによっても血中T4濃度が低下しますが,これは肝臓の薬物代謝酵素の誘導により,T4の胆汁への排せつが促進されるからです。
このような背景を踏まえ,ラットを用い妊娠中の低用量TCDD曝露が胎児の甲状腺機能に及ぼす影響を調べました。その結果,
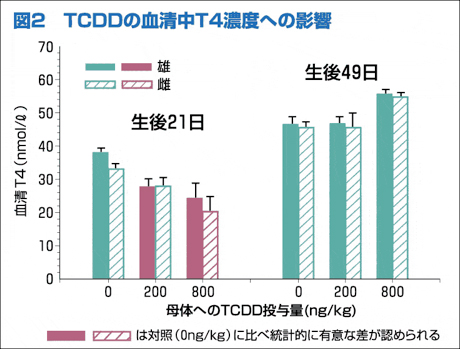
(1) 生後21日の200,800ng/kg投与群ラットの血清中のT4濃度は,対照群と比べ低下が認められた。しかし生後49日では対照群のレベルに回復した(図2)。
(2) 生後21,49日で200ng/kg投与群において,TCDDによって発現が誘導される薬物代謝酵素であるCYP1A1は顕著な誘導が認められた。
(3) 生後21日で200ng/kg以上の投与群において,甲状腺ホルモンの分解に重要な役割を果たす酵素(UGT-1)の発現誘導が見られたが,49日では対照群のレベルに回復した。
(4) 血清と臓器中のTCDD濃度は,生後21日で最高値を示したが,生後49日では著しく減少した。
生後21日のラットの血中T4濃度の低下は,TCDDによる肝臓のUGT-1の誘導とそれによるT4の胆汁への排せつ促進によることが推測されました。
なお組織病理所見で,生後49日の800ng/kg投与群で甲状腺の過形成(細胞数の増加)が観察され,甲状腺ろ胞細胞の著しい増加が認められました。T4が対照群と同じレベルに戻っても,組織学的には不可逆的な影響が残っていることが示されました。これは,妊娠期の低濃度TCDDの1回の投与により,子の甲状腺の過形成が示された初めての報告です。

4.免疫機能への影響
免疫系は内分泌系と相互に密接な関連を持ち,発生過程や生殖機能にも関係しています。そこで低用量のTCDDを投与した妊娠ラットから胎盤を経た,あるいは授乳による曝露が,子の免疫系に及ぼす影響を調べるため,T細胞(Tリンパ球)の分化の場である胸腺および主な免疫反応の場の一つである脾臓への影響を検討しました。
(1) 生後21,49,120日の胸腺および脾臓重量は,対照群と差はなかった。
(2) 胸腺の組織重量当たりの細胞数は,生後21,49日で差はなかった。しかし生後120日では,TCDDの投与量に従って組織重量当たりの細胞数の減少が認められた。一方脾臓では,生後49日でTCDDの投与量に従って組織重量当たりの細胞数の減少が見られ,800ng/kg投与の子においてはそれが明確に認められた。
(3) 胸腺におけるCYP1A1mRNAの誘導は,生後5日の50ng/kg以上投与の子で明らかに認められたが,生後21,49日と経時的に減少していった。これに対して脾臓ではCYP1A1mRNAの誘導は非常に弱かった。
妊娠期投与のTCDDは免疫器官,とくに思春期のラットの脾臓に影響を及ぼしていることがわかりました。またTCDDは,細胞内レセプターであるアリルハイドロカーボンレセプター(AhR)と結合した後,CYP1A1やUGT-1を誘導し,毒性を現わします。今回の研究では上の結果が示すように,TCDDがAhRと結合したことにより発現した遺伝子による直接的な影響というよりは,内分泌系などを通じた間接的な影響であることが推測されました。
脾臓細胞数の減少は,免疫機能の低下につながることが予想されますが,実際にどのような免疫機能に変化が起こるかについては,今後の検討が必要です。
5.TCDDの母体から子への移行
近年,われわれを含めいくつかの研究グループが,妊娠動物へのTCDDの投与実験を行い,発生・分化段階の胎児や新生児は,成体よりもはるかに感受性が高いことを明らかにしています。しかし障害が生じた出生子に対し,母親の妊娠期間中あるいは授乳期間中にどの程度ダイオキシン類が移行しているのかは,あまり知られていません。そこで妊娠ラットにTCDDを投与し,胎児,出生児への影響と,妊娠期だけではなく授乳期の母体,胎児および出生児体内の TCDD濃度を調べました。その結果は,
(1) 800ng/kg投与群の母体から胎児の移行量は,一腹当たり0.7〜2.0ngで,これは投与したTCDDの0.2〜0.6% に相当した。
(2) 生後2日のTCDD濃度は,どの投与量のラットにおいても出産直前の妊娠20日の胎児と比べ約4倍高かった(表1)。
これは出生直前の急激な成長に伴い,血液を通じあるいは出生後の授乳によって急激にTCDDが母親から子へ移行したためと考えられました。TCDDは妊娠期間よりも授乳期間に多く親から子へ移行することが明らかになりました。
表1.母親からのTCDD移行量(妊娠16,20日と生後2日)
| 妊娠 | 対照 | 50 | 200 | 800 |
| 妊娠16日 | 7.2 | 31.6 | 95.9(pg/wet-g) | |
| 1腹当たり | − | 40 | 155 | 711(pg) |
| 妊娠20日 | 5.4 | 16.6 | 47.6(pg/wet-g) | |
| 1腹当たり | − | 310 | 702 | 1990(pg) |
| 生後2日 | 22.1 | 64.3 | 207(pg/wet-g) |


