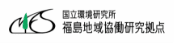薬剤耐性菌がもたらす脅威
薬剤耐性菌を知っていますか?
私たちは細菌が原因の感染症にかかると病院で抗菌薬を処方してもらいますが、起因菌が薬剤耐性菌の場合、抗菌薬が効かずに感染症が治らないことがあります。
薬剤耐性菌はサイレントパンデミックをもたらすと言われ、2019年には世界で495万人(関連死を含む)が薬剤耐性菌が原因で死亡したとされています[1]。
また、このまま適切な対策を講じなければ、2050年には薬剤耐性菌による死者数は癌による死者数を越えるとも推計されています[2]。
野生動物と薬剤耐性菌の関係
薬剤耐性菌感染症を食い止めるためには、病院の中だけの対策で十分なのでしょうか。
近年大流行した新型コロナウイルスもそうですが、人や動物(家畜やペット、野生動物)を相互に伝播する人獣共通感染症は感染症全体の約6割を占めると言われています。
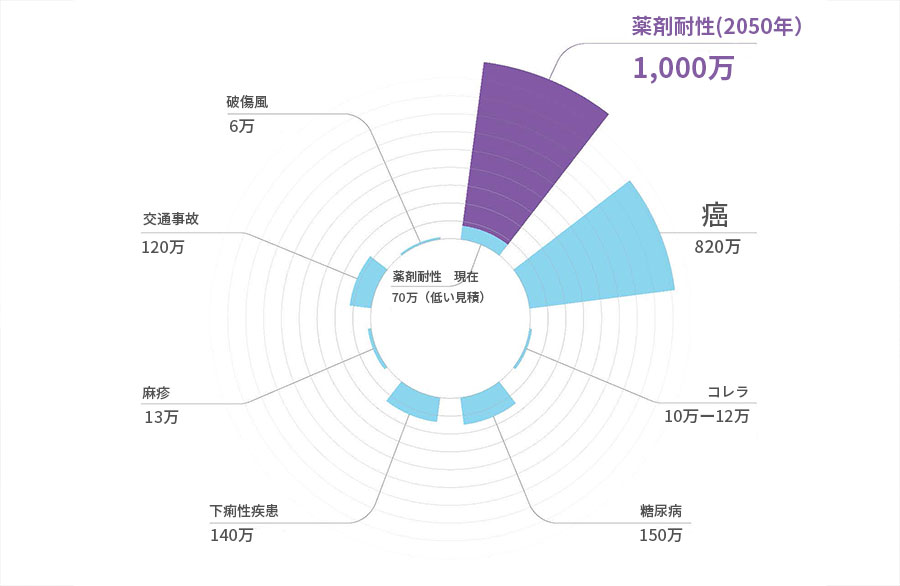
このような背景を受け、近年ではワンヘルス・アプローチと言う、人と動物、環境の健康(健全性)は一つであり、関係者が協力して問題の解決に取り組む考え方が普及しつつあります。
人獣共通感染症だけでなく薬剤耐性についてもこの概念が該当し、畜産現場での薬剤耐性菌発生の低減や、汚水などを介した環境への排出防止も対策方針として取り入れられています。
野生動物も例外ではなく、とくに広い行動圏を持ち生態系の中で多様な作用を持つ哺乳類や鳥類は、自然環境での汚染の指標となる可能性や、環境中に耐性菌を拡散させる可能性が指摘されています。
野生動物に関しては生息環境によって耐性菌の保有状況が異なります。
これまで国外で行われた研究から、人間社会の近くに生息する野生動物は臨床的に重要な抗菌薬に対する耐性菌を保有しやすいことが分かっています[3,4]。
筆者が過去に行った国内のシカを対象とした調査でも類似の結果が得られていることから[5]、『人間活動』の程度は野生動物における耐性菌分布を考える上でひとつの鍵になると考えています。
しかし、具体的にどのような要因が野生動物における薬剤耐性菌保有を促進するのかは分かっていません。

人の影響は小さい、それとも大きい?無居住化地域の野生動物
福島県には原発事故に伴う住民避難によって人が住んでいない地域があります。
これらの地域では野生動物が市街地へ出没し、家屋侵入などの被害を引き起こしたため、環境省により被害軽減のための捕獲が行われています。
前述の通り、野生動物の耐性菌獲得には人間活動の影響が大きいと考えられています。
福島県の帰還困難区域のように、『人は住んでいないけれども、人工物が残されている』といった環境は、地方過疎化が進む今、今後全国的にも増加する可能性があります。
しかし、このような環境での野生動物における耐性菌の獲得や伝播様式は全く分かっていません。

帰還困難区域周辺では、現在では特定復興再生拠点区域の設定やその除染・インフラ整備等をはじめ、将来的な住民帰還や新規居住を見据えたまちづくりの計画が着実に進んでいます。
このような中、当該地域での公衆衛生の確保は非常に重要であり、対策を検討する上で野生動物を対象としたサーベイランス(時間的、空間的な保有状況や耐性菌株の特徴の分析)は有効と考えます。
これに加え、帰還困難区域外の様々な環境に生息する野生動物でも同時にデータを収集し解析することで、生息環境の特徴や野生動物の生息密度が耐性菌の獲得や伝播にどのように影響するかを明らかにしたいと考えています。
野生動物が薬剤耐性菌を持つことのリスク
日本のような衛生環境が良い国において、野生動物が持つ耐性菌が人や動物(家畜やペット)へどのように伝播するかについてはあまりよく分かっていません。
近年では野生動物の市街地や農地への出没など、野生動物と人間社会との接点は増えつつあり、両者間での伝播は起こりやすい状況が生じていると考えられます。

一方で、仮に野生動物から人や家畜等への伝播が起こったとしても、元の保有率が人や家畜で高い環境においては、野生動物由来の耐性菌の影響は小さいと捉えることもできます。
現段階で重要なことは、野生動物を含む環境中での耐性菌の分布特性や病原性、人や家畜との相互の伝播経路の有無、耐性菌の野生動物自身への影響、野生動物の中での耐性菌の進化等についての知見を積み重ねることだと思います。
本研究が福島県の復興や野生動物における薬剤耐性菌モニタリング体制の構築に少しでもお役に立てるよう、日々励んでいきたいと思います。
あわせて読みたい
参考文献
- Antimicrobial Resistance Collaborator (2022) Global burden of bacterial antimicrobial resistance in 2019: a systematic analysis. Lancet 399:629-655.
- O’Neill J (2016) Tackling drug-resistant infections globally: final report and recommendations. The Review on Antimicrobial Resistance, Government of the United Kingdom, London.
- Hassell JM (2019) Clinically relevant antimicrobial resistance at the wildlife–livestock–human interface in Nairobi: An epidemiological study. Lancet Planet Health 3:e259–e269.
- Wyrsch ER (2022) Urban wildlife crisis: Australian silver gull is a bystander host to widespread clinical antibiotic resistance. mSystems 7:00158-22.
- Ikushima S (2023) Characterization of quinolone-resistant and extended-spectrum β-lactamase-producing Escherichia coli derived from sika deer populations of the Nara Prefecture, Japan. J Vet Med Sci 85:937-941.